Puku (Kobus vardonii)
Le puku (Kobus vardonii) est un mammifère artiodactyle appartenant à la famille des bovidés dans le genre Kobus. Espèce typiquement africaine, cette antilope de taille moyenne occupe principalement les savanes herbeuses humides du sud-centre du continent, notamment en Zambie, en Tanzanie et dans certaines zones limitrophes du Malawi, de l’Angola ou encore de la République démocratique du Congo. Le puku est également appelé Cobe de Vardon, nom qui rend hommage au Major John Vardon, un explorateur ou administrateur britannique du XIXe siècle qui a participé à des campagnes coloniales et d’exploration dans l’intérieur sud-africain.

© Ryan van Huyssteen - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)Le puku est une antilope de taille moyenne qui se distingue par une silhouette robuste, des proportions harmonieuses et une musculature développée, surtout au niveau de l’arrière-train. Il mesure généralement entre 70 et 85 centimètres au garrot, avec une longueur corporelle allant de 130 à 160 centimètres. Le poids des mâles varie entre 70 et 90 kilogrammes, tandis que celui des femelles est légèrement inférieur, oscillant entre 60 et 75 kilogrammes. Cette différence de masse corporelle, bien que modérée, témoigne d’un léger dimorphisme sexuel également observable dans la longueur et la forme des cornes.
Le pelage du puku est d’un brun doré à brun roux uniforme, avec des nuances plus claires sur les flancs et la partie ventrale. Cette robe monochrome lui permet de se fondre efficacement dans les herbes hautes et les savanes boisées. Le dessous de l’abdomen, l’intérieur des jambes et la région périnéale sont généralement plus pâles, tirant sur le crème. Le museau est souvent légèrement plus foncé, tandis que les lèvres, le contour des yeux et les oreilles arborent parfois des zones décolorées ou plus claires. Le pelage est relativement dense et mi-long, ce qui protège l’animal des parasites et des variations thermiques, en particulier durant la saison humide.
Les mâles se reconnaissent facilement à leurs cornes annelées, en forme de lyre, qui mesurent en moyenne entre 50 et 65 centimètres. Ces cornes, incurvées vers l’arrière puis vers l’avant, sont solides et servent principalement dans les affrontements hiérarchiques entre individus concurrents. Les femelles, quant à elles, sont dépourvues de cornes. La tête du puku est allongée, avec un museau étroit, des oreilles dressées et mobiles, et de grands yeux sombres qui lui procurent une vision panoramique bien adaptée à la surveillance de l’environnement.
Les membres du puku sont relativement courts mais puissants, bien adaptés à la course sur terrain humide ou détrempé. Les sabots sont larges et évasés, ce qui améliore la stabilité et limite l’enfoncement dans les sols mous. Cette morphologie est un excellent exemple d’adaptation à la vie dans des zones de marais ou de prairies inondables. La queue du puku mesure environ 30 centimètres, est touffue à son extrémité et est souvent agitée pour éloigner les insectes.

© Hans Hillewaert - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
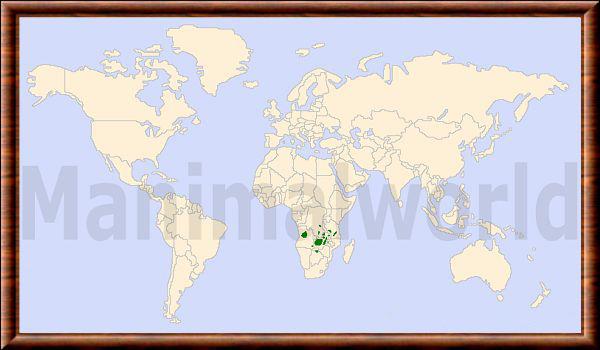
CC-BY-SA (Certains droits réservés)Le puku était autrefois largement répandu dans les prairies proches des points d'eau permanents, dans les savanes boisées et les plaines inondables du centre-sud de l'Afrique. Il a été éliminé de grandes parties de son ancienne aire de répartition et réduit à des populations fragmentées et isolées, mais certaines d'entre elles sont encore nombreuses. On n'en trouve désormais qu'un grand nombre dans deux pays, la Tanzanie et la Zambie. Des populations de puku sont encore présentes dans le nord-est du Botswana, dans la plaine inondable du fleuve Chobe, et elles sont présentes en vagabondage dans la moyenne vallée du Zambèze au Zimbabwe et dans la bande orientale de Caprivi en Namibie. En Zambie, environ 85 % des Puku vivent dans des zones protégées.
Le puku occupe les prairies proches des points d'eau permanents dans les savanes boisées et les plaines inondables du centre-sud de l'Afrique. Bien qu'associé aux zones humides et à la végétation marécageuse, le puku évite les eaux stagnantes profondes et, de ce fait, se distinguent écologiquement du cobe lechwe.
© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
CC-BY-NC-SA (Certains droits réservés)Le puku est un herbivore strict, principalement brouteur, qui se nourrit presque exclusivement d’herbes et de graminées présentes dans les savanes humides, les plaines inondables et les zones marécageuses. Il privilégie les pâturages composés de Panicum, Brachiaria, Setaria, Eragrostis ou Hyparrhenia, qu’il consomme en choisissant les pousses tendres et riches en eau. Cette préférence pour les jeunes pousses s’explique par leur meilleure digestibilité et leur plus grande teneur en protéines. Le puku peut aussi, à l’occasion, ingérer des plantes herbacées non graminéennes, en particulier durant la saison sèche lorsque la biomasse herbacée est réduite.
L’alimentation du puku est étroitement liée au rythme des saisons. Pendant la saison des pluies, il bénéficie d’une grande abondance de nourriture de haute qualité, ce qui permet aux femelles de constituer les réserves énergétiques nécessaires à l'élevage de leurs petits. À l’inverse, durant la saison sèche, la disponibilité alimentaire diminue et les animaux doivent parfois parcourir de longues distances à la recherche de zones encore verdoyantes ou humides, souvent le long des berges de rivières ou dans les zones résiduelles d’inondation.
Comme chez la plupart des ruminants, la mastication est suivie d’un processus de rumination qui permet de broyer finement les fibres végétales et d’extraire un maximum de nutriments. Cette digestion est facilitée par la flore microbienne intestinale spécialisée dans la fermentation des fibres. Le puku a besoin d’un accès régulier à l’eau, et bien qu’il tire une part importante de son hydratation de son alimentation, il boit presque quotidiennement lorsque l’eau est accessible. Cela le rend vulnérable aux modifications hydrologiques de son habitat.
Enfin, l’équilibre alimentaire du puku peut être compromis par la concurrence avec le bétail domestique, qui pâture parfois sur les mêmes territoires, notamment dans les zones proches des villages. Cette compétition pour les ressources fourragères, exacerbée pendant la saison sèche, peut affecter la condition corporelle et la reproduction des individus, surtout dans les populations déjà fragmentées ou sous pression.

© Michal Sloviak - BioLib
 All rights reserved (Tous droits réservés)
All rights reserved (Tous droits réservés)La reproduction du puku présente un ensemble de caractéristiques typiques des antilopes grégaires vivant en milieux ouverts, avec une organisation sociale marquée et un système de reproduction polygame. Chez cette espèce, les mâles établissent et défendent des territoires pendant la saison de reproduction afin d’attirer les femelles. Les mâles matures commencent à marquer activement leur territoire par l’intermédiaire de dépôts de glandes préorbitaires, d’urinage, et de raclures du sol avec les sabots. Ces territoires, de petite taille (souvent moins d’un hectare), sont rigoureusement défendus contre d'autres mâles, notamment par des démonstrations visuelles, des vocalisations graves, des postures dominantes, voire des affrontements directs. Ces combats, bien qu’intimidants, se terminent rarement par des blessures graves, car ils obéissent à un code d’escalade progressive destiné à éviter les dommages.
La gestation dure environ 7 à 8 mois (soit entre 210 et 240 jours), ce qui est relativement long pour une antilope de cette taille. Le pic des naissances survient généralement à la fin de la saison des pluies ou au début de la saison sèche, période durant laquelle l’herbe est encore abondante et permet aux mères d’assurer une lactation optimale. Les femelles mettent bas un seul petit, rarement deux, qu’elles dissimulent dans les hautes herbes durant les premières semaines. Cette stratégie de nidification, où le petit reste caché pendant que la mère vient l’allaiter plusieurs fois par jour, limite les risques de prédation dans un environnement ouvert.
Le jeune puku est capable de se lever et de marcher quelques heures après la naissance, mais il reste vulnérable pendant ses premières semaines. Après une phase de dissimulation, il suit sa mère et est progressivement intégré au groupe. Le sevrage intervient aux alentours de 4 à 6 mois, bien qu’il puisse varier selon les conditions environnementales. Les femelles atteignent la maturité sexuelle vers 12 à 18 mois, tandis que les mâles, bien qu’ayant la capacité de se reproduire à cet âge, doivent attendre souvent jusqu’à l’âge de 4 ou 5 ans pour pouvoir accéder à un territoire reproducteur et avoir une chance de s’accoupler.
Le puku a une espérance de vie moyenne de 10 à 12 ans à l’état sauvage, bien que certains individus puissent atteindre jusqu’à 15 ans dans des conditions particulièrement favorables, comme dans des réserves protégées. Dans la nature, la durée de vie effective est souvent limitée par la prédation, les maladies, les sécheresses prolongées et la concurrence pour les ressources. En captivité, où les risques de prédation et les maladies sont réduits, sa longévité peut s’étendre jusqu’à 17 ans.

© Charles J. Sharp - Sharp Photography
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)Le comportement du puku est modelé par la nécessité d'assurer sa survie dans des écosystèmes à la fois riches et changeants. Animal essentiellement diurne et crépusculaire, le puku adopte une activité de type cathemeral, alternant les phases de repos et de pâture tout au long de la journée. Il tend toutefois à concentrer ses périodes de pâturage aux heures fraîches du matin et du soir, tandis que les heures les plus chaudes sont consacrées au repos et à la rumination.
Le puku vit en petits groupes sociaux composés soit de femelles et de leurs jeunes, soit de mâles célibataires. Les groupes de femelles sont généralement stables et comptent entre 5 et 15 individus, parfois davantage dans les zones où la densité est élevée. Ces groupes sont dirigés par une femelle dominante et présentent une forte cohésion sociale. Les interactions intra-groupe comprennent des comportements affiliatifs tels que le toilettage mutuel, le frottement de la tête et des vocalisations douces. Les jeunes y bénéficient d’un apprentissage comportemental basé sur l’imitation et l’observation des adultes. Les mâles exclus de la reproduction forment des groupes de célibataires où les tensions sont moindres que dans les zones de reproduction. Ces regroupements sont essentiels pour les jeunes mâles qui acquièrent ainsi les codes sociaux nécessaires avant de devenir compétitifs. Les mâles matures, en revanche, adoptent une stratégie territoriale isolée, qui les conduit souvent à se séparer des groupes pour défendre un espace de reproduction.
Ce bovidé communique à l’aide de signaux visuels, vocaux et chimiques. Les postures corporelles, comme l’érigement du cou, la présentation latérale ou les bonds verticaux (stotting), sont utilisées pour intimider les rivaux ou avertir les congénères d’un danger. Les vocalisations comprennent des grognements graves et des appels d’alarme courts et secs en cas de menace. Les dépôts glandulaires et les traces d’urine jouent aussi un rôle important dans le marquage de territoire et l’identification individuelle.
Le puku est souvent en compétition avec d’autres espèces herbivores partageant son habitat, notamment les grands cobes des roseaux (Redunca arundinum), les cobes lechwe (Kobus leche) ou encore certains types de bétail introduit par l’homme. Il ajuste ses plages d’activité et ses choix alimentaires en fonction de la densité d’occupation et des niveaux d’inondation, démontrant ainsi une grande flexibilité écologique.

© Arturo de Frias Marques - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)Le puku, en tant qu'antilope de taille moyenne vivant dans les prairies herbeuses et les savanes humides d’Afrique centrale, fait face à une pression de prédation constante tout au long de sa vie. Son mode de vie grégaire, son activité diurne et sa préférence pour les zones ouvertes mais proches des points d’eau en font une cible fréquente pour de nombreux carnivores. Les prédateurs naturels du puku varient sont :
* Lion : Le lion (Panthera leo) est sans doute le principal prédateur du puku dans les régions où leurs aires de répartition se chevauchent, notamment dans les savanes de Zambie, d’Angola et du nord du Botswana. Ce félin, qui chasse souvent en groupe, est capable de s’attaquer à des proies beaucoup plus grandes que le puku, mais celui-ci constitue néanmoins une cible de choix par sa taille moyenne, sa relative abondance locale et sa préférence pour les milieux ouverts. Les lions s’attaquent aussi bien aux adultes qu’aux jeunes. Ils utilisent généralement des techniques d’embuscade, approchant silencieusement à couvert avant de déclencher une attaque soudaine. Les puku, bien que dotés d’une bonne vitesse de fuite, ont du mal à échapper à un groupe de lions bien coordonné, surtout si la couverture végétale est faible ou si l’animal est isolé.
* Léopard : Le léopard (Panthera pardus) est un prédateur opportuniste, agile et discret, qui se sert de la couverture végétale pour surprendre ses proies. Bien qu’il préfère les forêts, les fourrés denses et les lisières boisées, il chasse également dans les plaines humides en bordure des marais où se trouvent les pukus. Le léopard s’attaque surtout aux jeunes ou aux individus isolés, mais peut tuer un adulte s’il a l’avantage de la surprise. Son agilité lui permet aussi de hisser ses proies dans les arbres, ce qui évite qu’elles soient dérobées par des hyènes ou des lions.
* Hyène tachetée : Les hyènes tachetées (Crocuta crocuta), très présentes dans les habitats du puku, sont des chasseurs efficaces et aussi des charognards. Elles chassent souvent en clans et peuvent poursuivre leurs proies sur de longues distances, épuisant ainsi les animaux plus petits comme les pukus. Elles utilisent leur endurance et leur organisation sociale pour harceler des groupes entiers d’herbivores, isolant les plus faibles ou les plus jeunes. Les hyènes sont capables de tuer des adultes mais s’attaquent plus volontiers aux juvéniles, aux femelles en gestation ou aux individus affaiblis. Dans certains parcs zambiens, comme le parc national de Sud Luangwa, elles représentent une part importante de la mortalité chez les antilopes locales, y compris le puku.
* Lycaon : Le lycaon (Lycaon pictus), ou chien sauvage africain, est un prédateur hautement efficace bien qu’en déclin dans de nombreuses régions. Là où il est encore présent, comme dans certaines zones protégées du Botswana, de Zambie ou de Namibie, il constitue une menace importante pour le puku. Chassant en meute très organisée, ce canidé peut faire preuve d'une coordination impressionnante pour cibler des groupes entiers d'herbivores, isoler les individus les plus vulnérables et les abattre rapidement. Le succès de chasse peut atteindre jusqu’à 80 % dans certains contextes, ce qui en fait l’un des carnivores les plus redoutables pour les antilopes. Ils privilégient souvent les jeunes et les femelles, mais n’hésitent pas à attaquer des adultes en pleine santé, profitant de leur surnombre et de leur stratégie de poursuite en relais.
* Guépard : Bien que moins répandu dans l’aire de distribution du puku que d’autres prédateurs, le guépard (Acinonyx jubatus) peut chasser le puku dans les savanes ouvertes où les deux espèces coexistent. Spécialiste de la vitesse, le guépard préfère les proies légères et isolées. Les jeunes pukus ou les adultes de petite taille peuvent donc être ciblés. Toutefois, cette prédation reste marginale comparée à celle exercée par les lions ou les lycaons.
* Rapaces : Les jeunes pukus, surtout dans leurs premières semaines de vie lorsqu’ils sont dissimulés dans la végétation, sont exposés à la prédation par de grands rapaces, notamment les aigles tels que l’aigle martial (Polemaetus bellicosus) ou l'aigle couronné (Stephanoaetus coronatus). Ces oiseaux puissants peuvent s’envoler avec un faon entier ou le tuer sur place. Cette menace est particulièrement forte dans les zones boisées jouxtant les marécages où les femelles puku mettent bas.
* Python de Seba : Le python de Seba (Python sebae) est un grand serpent constricteur capable d’atteindre plusieurs mètres de long. Il est connu pour s’attaquer à de jeunes antilopes et même parfois à des adultes de petite taille. Il capture ses proies en embuscade, enroulant son corps autour d’elles avant de les étouffer. Bien que ce type de prédation soit rare et localisé, il représente un danger silencieux pour les jeunes puku évoluant dans les hautes herbes ou en bordure de zones boisées.
Le comportement antiprédation du puku repose principalement sur la vigilance collective et la fuite. Lorsqu’un danger est détecté, un individu émet un cri d’alarme, et l’ensemble du groupe prend la fuite dans une direction coordonnée. Les pukus préfèrent fuir vers les zones herbeuses inondées, qui leur offrent une meilleure chance d’échapper aux prédateurs terrestres. Ils sont capables de courir rapidement, mais privilégient l’endurance et les détours à travers des terrains détrempés pour distancer leurs poursuivants.

© Hans Hillewaert - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)La fragmentation de l'habitat causée par l'expansion des implantations humaines et des cultures constitue une menace majeure pour les populations de puku. Le système social et reproducteur est particulièrement vulnérable aux perturbations causées par la fragmentation de l'habitat et la chasse, avec l'impact à long terme d'un effondrement du recrutement de la population. Dans la vallée du Kilombero, Jenkins et al. (2002) ont signalé que la principale menace pesant sur le puku provenait de l'expansion des troupeaux de bovins à la limite de la plaine inondable et des dommages causés à l'habitat de saison des pluies par les agriculteurs qui défrichaient les forêts de miombo. La chasse non durable et, en particulier, le braconnage intensif semblent avoir extirpé le puku de sites répartis sur l'ensemble de son aire de répartition.

© Michal Sloviak - BioLib
 All rights reserved (Tous droits réservés)
All rights reserved (Tous droits réservés)Le puku est actuellement considéré comme une espèce moyennement menacée. Il est inscrit dans la catégorie "Quasi menacé" (NT) sur la Liste rouge de l'IUCN.
East (1999) a estimé qu'environ un tiers de la population totale survit dans des zones protégées. Outre la vallée de Kilombero, les zones clés pour la survie du puku comprennent : Katavi-Rukwa (Tanzanie), le parc national de Kafue, les parcs nationaux de Nord Luangwa et Sud Luangwa, Kasanka et Nsumbu-Tondwa-Mweru Wantipa (Zambie). On trouve des populations plus petites dans les parcs nationaux de Kasungu (Malawi) et de Chobe au Botswana (East 1999). Environ 85 % des pukus de Zambie se trouvent dans des zones protégées (Jenkins 2013). Les actions prioritaires pour la conservation du puku dans toute son aire de répartition ont été discutées par Jenkins (2013).

© Lubomír Prause - BioLib
 All rights reserved (Tous droits réservés)
All rights reserved (Tous droits réservés)Le puku a été décrit pour la première fois en 1857 par le missionnaire et explorateur écossais David Livingstone dans son ouvrage "Missionary Travels and Researches in South Africa. Dans ce livre, Livingstone relate ses observations de la faune africaine, y compris une antilope qu'il nomme Kobus vardonii, en hommage à son ami Frank Vardon. Le lieu type de cette espèce est situé à environ 30 à 40 miles au-dessus de Libonta, identifié aujourd'hui comme la région de Barotseland en Zambie, dans la vallée du Chobe, près de Libonda.Depuis cette description initiale, Kobus vardonii a été reconnu comme une espèce distincte au sein du genre Kobus, qui comprend plusieurs antilopes africaines adaptées aux milieux humides. Les études taxonomiques ultérieures ont confirmé la validité de cette espèce, et elle est actuellement classée dans la sous-famille des Reduncinae, famille des Bovidae.
Le puku comprend deux sous-espèces officiellement reconnues par des autorités taxonomiques telles que l'Integrated Taxonomic Information System (ITIS) et Mammal Species of the World (MSW) :
* Kobus vardonii vardonii (Livingstone, 1857) : Il s'agit de la sous-espèce nominale, décrite par Livingstone. Elle est largement répandue dans le sud de la République démocratique du Congo, en Zambie, au nord du Botswana et dans certaines régions d'Angola.
* Kobus vardonii senganus (Sclater & Thomas, 1897) : Cette sous-espèce, parfois appelée puku de Senga, a été décrite à la fin du XIXe siècle. Elle est principalement présente dans la région de Senga en Zambie.
Les distinctions entre ces deux sous-espèces reposent sur des variations morphologiques mineures et des différences géographiques. Bien que certaines sources aient remis en question la validité de ces sous-espèces en raison de la variabilité individuelle et du chevauchement des caractéristiques, elles restent reconnues dans des bases de données taxonomiques établies.
L’étude de Birungi & Arctander (2000) a apporté un élément crucial au débat phylogénétique, en montrant une proximité génétique forte entre le cobe de Buffon (Kobus kob) et le puku. Cependant, en l’absence de données génomiques plus complètes (y compris nucléaires), le statut spécifique du puku est maintenu dans les classifications actuelles, tout en restant potentiellement sujet à révision à l’avenir si de nouvelles études intégratives (morpho-génétiques et écologiques) viennent renforcer cette hypothèse.

© Oleg Sapon - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)| Nom commun | Puku |
| Autre nom | Cobe de Vardon |
| English name | Puku |
| Español nombre | Pucú |
| Règne | Animalia |
| Embranchement | Chordata |
| Sous-embranchement | Vertebrata |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Eutheria |
| Ordre | Artiodactyla |
| Sous-ordre | Ruminantia |
| Famille | Bovidae |
| Sous-famille | Reduncinae |
| Genre | Kobus |
| Nom binominal | Kobus vardonii |
| Décrit par | David Livingstone |
| Date | 1857 |
Satut IUCN |  |
* Liens internes
 Liste Rouge IUCN des espèces menacées
Liste Rouge IUCN des espèces menacées
 Système d'information taxonomique intégré (ITIS)
Système d'information taxonomique intégré (ITIS)
* Liens externes
 Global Biodiversity Information Facility (GBIF)
Global Biodiversity Information Facility (GBIF)
* Bibliographie
 Kingdon, J. (2015). The Kingdon Field Guide to African Mammals. Bloomsbury Publishing.
Kingdon, J. (2015). The Kingdon Field Guide to African Mammals. Bloomsbury Publishing.
 Estes, R. D. (1991). The Behavior Guide to African Mammals: Including Hoofed Mammals, Carnivores, Primates. University of California Press.
Estes, R. D. (1991). The Behavior Guide to African Mammals: Including Hoofed Mammals, Carnivores, Primates. University of California Press.
 Wilson, D. E., & Mittermeier, R. A. (Eds.). (2011). Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions.
Wilson, D. E., & Mittermeier, R. A. (Eds.). (2011). Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions.
 Buntjer, J. B., Otsen, M., Nijman, I. J., Kuiper, M. T. R., & Lenstra, J. A. (2002). Phylogeny of Bovidae based on multiple microsatellites. Mammalian Genome, 13(6), 328–333.
Buntjer, J. B., Otsen, M., Nijman, I. J., Kuiper, M. T. R., & Lenstra, J. A. (2002). Phylogeny of Bovidae based on multiple microsatellites. Mammalian Genome, 13(6), 328–333.
 Hassanin, A., Delsuc, F., Ropiquet, A., Hammer, C., van Vuuren, B. J., Matthee, C., ... & Douzery, E. J. P. (2012). Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), combining phylogenomic and supertree approaches. Zoologica Scripta, 41(5), 435–457.
Hassanin, A., Delsuc, F., Ropiquet, A., Hammer, C., van Vuuren, B. J., Matthee, C., ... & Douzery, E. J. P. (2012). Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), combining phylogenomic and supertree approaches. Zoologica Scripta, 41(5), 435–457.


