Lycaon (Lycaon pictus)
Le lycaon (Lycaon pictus) est un canidé emblématique des savanes et des zones boisées d'Afrique. Reconnaissable à son pelage tricolore unique et à ses grandes oreilles arrondies, il se distingue par son organisation sociale complexe et sa grande cohésion de groupe. Autrefois répandu à travers la quasi-totalité du continent africain, sa survie est aujourd'hui menacée par la perte d'habitat, les conflits avec les humains et les maladies. Ce magnifique prédateur joue un rôle écologique essentiel dans la régulation des populations d’herbivores. L’étude de sa biologie, de son comportement et de sa taxonomie révèle l’extraordinaire adaptation du lycaon à son environnement, ainsi que les menaces qui pèsent sur sa survie. Le lycaon est également appelé Chien sauvage d'Afrique ou Loup peint.

© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
CC-BY-NC-SA (Certains droits réservés)La morphologie du lycaon est remarquablement adaptée à son mode de vie de chasseur endurant. Mesurant environ 75 à 110 cm de long pour une hauteur au garrot de 60 à 75 cm et un poids variant de 20 à 30 kg, le lycaon est un canidé élancé. Son corps mince et musclé est conçu pour la vitesse et l'endurance, lui permettant de poursuivre ses proies sur de longues distances.
Le pelage est très caractéristique et sert de principale caractéristique d'identification; il est composé de taches irrégulières noires, jaunes et blanches, formant des motifs uniques à chaque individu, à la manière d'une empreinte digitale. Cette coloration cryptique aide à camoufler l'animal dans son environnement naturel. Il y a peu de variations dans les marques faciales, le museau étant noir, devenant progressivement brun sur les joues et le front. Une ligne noire s'étend sur le front, virant au brun noirâtre à l'arrière des oreilles. Quelques spécimens arborent une marque brune en forme de larme sous les yeux. L'arrière de la tête et le cou sont bruns ou jaunes. Une tache blanche apparaît parfois derrière les pattes antérieures, certains spécimens ayant les pattes antérieures, la poitrine et la gorge complètement blanches.
La tête est relativement petite avec un museau court, et les grandes oreilles rondes et érigées sont très mobiles, offrant une ouïe exceptionnelle essentielle pour la chasse et la communication. Contrairement à d'autres canidés, le lycaon possède seulement quatre doigts par patte, dépourvu du premier doigt (ergot), une adaptation qui améliore sa vitesse et son efficacité lors de la course. La queue est longue et touffue, avec une pointe blanche distinctive qui pourrait servir de signal de ralliement visuel pour le groupe lors de la chasse. Sa dentition est également spécialisée, avec de puissantes prémolaires adaptées au déchiquetage de la viande, reflet de son régime alimentaire carnivore strict.

© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
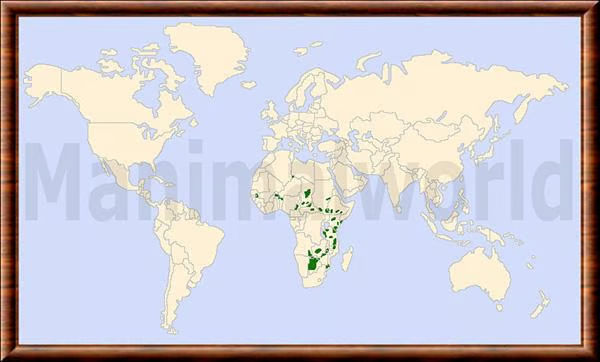
CC-BY-NC-SA (Certains droits réservés)Les données historiques indiquent que les lycaons africains étaient autrefois répartis dans toute l'Afrique subsaharienne, du désert aux sommets des montagnes, et n'étaient probablement absents que des forêts tropicales des basses terres et des déserts les plus secs. Ils ont disparu d'une grande partie de leur ancienne aire de répartition. L'espèce est pratiquement éradiquée d'Afrique du Nord et de l'Ouest, et considérablement réduite en Afrique centrale et en Afrique du Nord-Est. Les plus grandes populations se trouvent en Afrique australe (en particulier le nord du Botswana, l'ouest du Zimbabwe, l'est de la Namibie et l'ouest de la Zambie) et dans la partie sud de l'Afrique de l'Est (en particulier la Tanzanie et le nord du Mozambique).
La répartition géographique actuelle des lycaons africains a été estimée à l'aide des données compilées par le processus de planification de la conservation à l'échelle de l'aire de répartition de l'IUCN SSC pour les guépards et les lycaons africains, y compris les stratégies régionales et les plans d'action nationaux associés ultérieurs. L’aire de répartition actuelle du lycaon africain a été considérée comme comprenant uniquement "l’aire de répartition résidente" identifiée par les participants au processus de la CSE de l’IUCN : cela représente des terres où les participants étaient convaincus que la résidence du lycaon africain avait été confirmée au cours des 10 années précédentes. Les terres où la résidence n'était pas confirmée ont été exclues.
© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
CC-BY-NC-SA (Certains droits réservés)L'alimentation du lycaon est exclusivement carnivore, reposant principalement sur la chasse de proies de taille moyenne. Leur régime alimentaire varie en fonction de la disponibilité de la disponibilité de celles-ci dans leur habitat, mais il inclut généralement des impalas, des koudous, des gnous, des zèbres et diverses espèces d'antilopes.
Ce sont des chasseurs extrêmement efficaces, utilisant des stratégies de groupe sophistiquées pour épuiser et abattre leurs cibles. Les lycaons sont connus pour leur taux de réussite de chasse élevé, souvent supérieur à celui des autres grands prédateurs africains, grâce à leur endurance exceptionnelle et leur travail d'équipe coordonné. La chasse se déroule généralement à l'aube ou au crépuscule, lorsque les températures sont plus clémentes et la visibilité est réduite, offrant un avantage. Les membres du groupe se répartissent les rôles, certains menant la poursuite tandis que d'autres coupent les chemins de fuite de la proie. Une fois la victime abattue, le partage de la nourriture est une caractéristique clé de leur comportement social. Les lycaons laissent souvent les petits et les membres blessés ou âgés manger en premier, démontrant un altruisme marqué au sein de la meute.
Les lycaons sont également connus pour leur capacité à poursuivre des proies sur de très longues distances, atteignant des vitesses de pointe remarquables tout en maintenant une endurance impressionnante. Ce régime alimentaire strict et leur méthode de chasse collaborative sont essentiels à leur survie et à leur rôle de régulateurs des populations d'herbivores.

Crédit photo: Alex Kantorovich - Zooinstitutes
La reproduction du lycaon est fortement influencée par la structure sociale du groupe, dominée par un couple alpha, seul autorisé à se reproduire. L’accouplement a généralement lieu durant la saison sèche, entre mars et juin, selon les régions. Après une gestation d’environ 70 à 75 jours, la femelle met bas dans une tanière souterraine située à l’abri dans une zone tranquille. La portée comprend de 6 à 16 petits, un nombre élevé pour un canidé, et les naissances ont lieu en l’absence des mâles, qui assurent alors la protection du territoire.
Les petits naissent aveugles et totalement dépendants, et restent à l’intérieur de la tanière durant les trois à quatre premières semaines. Toute la meute participe à leur élevage, apportant la nourriture régurgitée à la mère et aux jeunes, garantissant ainsi leur survie. Le sevrage commence vers 10 semaines, et les jeunes commencent à suivre le groupe après deux à trois mois. La mortalité infantile est élevée en milieu naturel, en raison des prédateurs, des maladies, et des pressions anthropiques. Les jeunes atteignent la maturité sexuelle vers 18 à 24 mois. À ce stade, ils peuvent rester dans la meute ou former de nouveaux groupes en se dispersant, généralement en coalition unisexuée. La coopération reproductive, la solidarité au sein du groupe et la stricte hiérarchie font du lycaon un exemple remarquable de stratégie reproductive coopérative parmi les carnivores sociaux.
En milieu naturel, le lycaon vit en moyenne entre 7 et 10 ans, bien que certains individus puissent atteindre exceptionnellement 11 à 12 ans. La mortalité juvénile est élevée, notamment en raison de la prédation, des maladies et de la compétition interspécifique. En captivité, à l’abri de ces pressions, il peut vivre jusqu’à 13 à 15 ans, mais ces cas sont rares. La cohésion sociale de la meute et le soin collectif porté aux membres affaiblis contribuent à une espérance de vie relativement longue pour un canidé sauvage.

Crédit photo: Brendan Ihmig - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)Le comportement du lycaon est profondément enraciné dans sa structure sociale hautement organisée. Les lycaons vivent en meutes de 2 à 27 individus, bien que la taille moyenne se situe souvent entre 5 et 15. Ces groupes sont dominés par un couple alpha reproducteur, mais tous les membres participent activement aux activités du groupe, y compris la chasse, l'élevage des jeunes et la protection du territoire. La communication est multimodale, incluant des vocalisations variées comme des jacassements, des glapissements et des gémissements, ainsi que des signaux visuels et olfactifs. Les démonstrations de soumission et d'affection, telles que le léchage mutuel et les courbettes, sont courantes et renforcent les liens sociaux.
Leur stratégie de chasse collaborative est l'un des aspects les plus étudiés de leur comportement. Ils sont incroyablement efficaces, montrant une coordination et une communication remarquables pendant la poursuite des proies. Une fois la chasse terminée, le partage de la nourriture est non seulement équitable, mais les membres les plus faibles ou blessés sont prioritaires, ce qui souligne la force de leur cohésion sociale. Les lycaons sont également très territoriaux et marquent leur domaine avec des sécrétions glandulaires et des excréments. Ce sont des animaux diurnes, bien qu'ils puissent chasser à l'aube et au crépuscule pour éviter la chaleur du milieu de journée. Leur mode de vie nomade au sein de leur territoire est dicté par la disponibilité des proies, les poussant à parcourir de grandes distances.

© Laika ac - Wikimedia Commons
 CC-BY-SA (Certains droits réservés)
CC-BY-SA (Certains droits réservés)Malgré son efficacité en groupe, le lycaon doit faire face à plusieurs menaces naturelles au cours de sa vie. Parmi ses principaux prédateurs figurent le lion (Panthera leo) et la hyène tachetée (Crocuta crocuta), qui rivalisent avec lui pour les ressources alimentaires. Les lions représentent une menace directe : ils n’hésitent pas à tuer les lycaons, notamment les jeunes ou les individus isolés, sans forcément les consommer, éliminant ainsi des compétiteurs. Les hyènes, quant à elles, bien que rarement prédatrices actives des lycaons, sont de redoutables kleptoparasites : elles suivent les meutes, repèrent leurs chasses, et s’emparent des carcasses avec agressivité, souvent en surnombre. Cette concurrence alimentaire limite parfois la réussite des lycaons dans certaines zones riches en prédateurs dominants.
Les léopards (Panthera pardus) peuvent également tuer de jeunes lycaons s’ils en ont l’occasion, surtout près des tanières. En dehors des carnivores, les jeunes peuvent être victimes de rapaces ou de serpents lorsqu’ils sont encore dans la tanière. Toutefois, le principal facteur de mortalité chez le lycaon reste l’humain, par le biais du braconnage, des collisions routières, de l’empoisonnement indirect, et des maladies canines comme la rage ou la maladie de Carré, transmises par les chiens domestiques. Ces pathologies peuvent décimer des meutes entières. Enfin, la fragmentation de l’habitat expose les lycaons à un isolement génétique, à une diminution des proies disponibles et à une vulnérabilité accrue face aux prédateurs naturels et aux dangers anthropiques.

© Michael Gäbler - Wikimedia Commons
 CC-BY (Certains droits réservés)
CC-BY (Certains droits réservés)La fragmentation de l'habitat est la principale menace pour les lycaons, entraînant des conflits croissants avec les humains et le bétail, ainsi que la transmission de maladies. La mortalité d'origine humaine est une conséquence majeure, rendant la coexistence difficile en dehors des zones protégées sans une planification territoriale rigoureuse.
Même dans les grandes réserves, les lycaons sont confrontés à un "effet de bordure" significatif. Leurs vastes déplacements signifient qu'une réserve de 5 000 km² est entièrement considérée comme une bordure à leurs yeux, augmentant les risques de contact avec les activités humaines aux limites. Seules les très grandes réserves non clôturées peuvent offrir une protection substantielle, bien que les clôtures autour de petites réserves montrent une efficacité limitée.
De plus, les lycaons vivent à de faibles densités, même dans les zones bien protégées ou indépendantes comme le nord du Botswana. Cette faible densité est en partie due à la prédation par les lions et à la compétition avec les hyènes tachetées, maintenant leurs effectifs bien en deçà de ce que les proies disponibles pourraient supporter. Par exemple, la vaste réserve de Selous (43 000 km²) n'abrite qu'environ 800 lycaons.
De telles populations, souvent plus petites dans la plupart des réserves (ex: Niokolo-Koba avec 50-100 individus), sont vulnérables à l'extinction. Des événements "catastrophiques" comme des épidémies peuvent anéantir de petites populations, comme cela a été le cas dans la réserve du Serengeti. Les petites populations confinées dans des habitats réduits ou des petites réserves subissent un effet de bordure accru, les exposant à une mortalité disproportionnée due aux interactions humaines.

© Wil Algeria - Facebook
 Di-no license (Licence inconnue)
Di-no license (Licence inconnue)Le statut de conservation du lycaon est alarmant. L'espèce est classée "En danger" (EN) sur la Liste rouge de l'IUCN. Ce statut reflète un déclin significatif de leurs populations à travers leur aire de répartition historique, qui couvrait autrefois la majeure partie de l'Afrique subsaharienne.
Des stratégies de conservation ont été élaborées pour l'espèce dans toutes les régions d'Afrique Sillero-Zubiri et al. (2004), Woodroffe et al. (1997), et de nombreux États de l'aire de répartition ont utilisé ces stratégies comme modèles pour leurs propres plans d'action nationaux (Département de la faune sauvage et des parcs nationaux 2008, Wildlife Service 2010). Bien que chaque stratégie régionale ait été élaborée indépendamment par le biais d'un processus participatif distinct, les trois stratégies ont une structure similaire, comprenant des objectifs visant à améliorer la coexistence entre les populations et les lycaons, à encourager l'aménagement du territoire pour maintenir et étendre les populations de lycaons, à renforcer les capacités de conservation des lycaons dans les États de l'aire de répartition, à mener des actions de sensibilisation pour améliorer la perception du public à l'égard des lycaons à tous les niveaux de la société, et à garantir un cadre politique compatible avec la conservation des lycaons.
Plusieurs éléments d'information sont nécessaires pour permettre une conservation plus efficace des lycaons. Il s'agit notamment de :
1) le développement de méthodes rentables pour l'étude des lycaons à grande échelle géographique;
2) des études sur la répartition et le statut des lycaons, notamment en Algérie, en Angola, en République centrafricaine, au Tchad, en Somalie, au Soudan du Sud et au Soudan;
3) le développement de moyens locaux appropriés et efficaces pour réduire les conflits entre les lycaons et les agriculteurs;
4) l'établissement des techniques les plus efficaces et les plus durables pour protéger les lycaons des maladies;
5) la détermination des caractéristiques du paysage qui facilitent (ou empêchent) le déplacement des lycaons sur de longues distances et favorisent (ou bloquent) ainsi la connectivité du paysage.

© Marc Faucher - iNaturalist
 CC-BY-NC (Certains droits réservés)
CC-BY-NC (Certains droits réservés)L'histoire taxonomique du lycaon est une histoire relativement complexe marquée par des débats et des révisions. L'espèce a été décrite pour la première fois en 1820 par Coenraad Jacob Temminck, un zoologiste néerlandais. Temminck lui a donné le nom scientifique de Hyaena picta, le plaçant initialement dans le genre des hyènes en raison de certaines similitudes morphologiques, notamment sa grande taille et sa puissance. Cependant, cette classification fut rapidement remise en question. En 1827, Joshua Brookes, un anatomiste britannique, a réexaminé l'espèce et a reconnu ses caractéristiques distinctives qui le séparaient clairement des hyènes et même des autres chiens sauvages. Il a alors créé un nouveau genre unique pour cette espèce, le nommant Lycaon, dérivé du grec ancien "lykaon" signifiant "loup". Le nom complet est donc devenu Lycaon pictus, où "pictus" signifie "peint" en latin, en référence à son pelage tacheté et coloré. Cette classification a été largement acceptée depuis, soulignant l'unicité de l'espèce au sein de la famille des Canidae.
Malgré cette acceptation générale, la position phylogénétique exacte de Lycaon pictus au sein des Canidae a fait l'objet de discussions. Pendant un temps, il a été considéré comme étant étroitement lié aux loups et aux chiens domestiques. Cependant, des études génétiques plus récentes ont révélé que le lycaon représente une lignée distincte et ancienne, s'étant divergée relativement tôt des autres grands canidés comme les loups (Canis spp.) et les renards (Vulpes spp.). Ces analyses moléculaires ont confirmé la pertinence de son placement dans un genre monotypique (le lycaon étant le seul membre du genre), soulignant son caractère évolutif unique.
Historiquement, plusieurs sous-espèces de Lycaon pictus ont été proposées, principalement sur la base de différences morphologiques, de coloration du pelage et de répartition géographique. Toutefois, leur validité est controversée. Les études génétiques récentes tendent à montrer une faible divergence entre les populations, suggérant que Lycaon pictus forme une seule espèce génétiquement cohérente, bien que régionalement variable. Voici les principales sous-espèces historiquement reconnues :
- Lycaon pictus lupinus (Thomas, 1902) – Présent en Afrique de l’Est, notamment au Kenya et en Tanzanie. Souvent plus petit que pictus, avec un pelage moins contrasté et plus sombre.
- Lycaon pictus manguensis (Matschie, 1915) – Décrit à partir de spécimens de la région du bassin du Congo. Cette sous-espèce est aujourd’hui considérée comme douteuse par la plupart des taxonomistes, en raison de l’absence de différences génétiques ou morphologiques nettes.
- Lycaon pictus pictus (Temminck, 1820) – Type nominal originaire d’Afrique australe, notamment d’Afrique du Sud et du Botswana. Caractérisé par une coloration vive avec de grandes plages blanches sur les pattes et la queue.
- Lycaon pictus somalicus (Thomas, 1904) - Décrit pour des spécimens de la Corne de l’Afrique (Somalie, Éthiopie), aujourd’hui probablement éteint dans cette région. Pelage plus terne, à dominance brunâtre.
Malgré ces distinctions, la tendance actuelle, appuyée par l’IUCN et les bases de données taxonomiques modernes, est de considérer Lycaon pictus comme une espèce monotypique sans sous-espèces valides, en raison du manque de divergences génétiques claires. Les variations de robe et de taille sont désormais considérées comme des adaptations écologiques locales plutôt que des marqueurs taxonomiques stables.

© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
CC-BY-NC-SA (Certains droits réservés)| Nom commun | Lycaon |
| Autres noms | Chien sauvage d'Afrique Loup-peint |
| English name | African Wild Dog Painted Hunting Dog |
| Español nombre | Licaon |
| Règne | Animalia |
| Embranchement | Chordata |
| Sous-embranchement | Vertebrata |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Eutheria |
| Ordre | Carnivora |
| Sous-ordre | Caniformia |
| Famille | Canidae |
| Genre | Lycaon |
| Nom binominal | Lycaon pictus |
| Décrit par | Coenraad Jacob Temminck |
| Date | 1820 |
Satut IUCN |  |
Retrouvez ci-dessous une petite fiche simplifiée du lycaon pour les enfants afin qu'eux aussi puissent apprendre à connaître les différentes espèces animales peuplant notre belle planète.

© Manimalworld
 CC-BY-NC-SA (Certains droits réservés)
CC-BY-NC-SA (Certains droits réservés)* Liens internes
 Liste Rouge IUCN des espèces menacées
Liste Rouge IUCN des espèces menacées
 Mammal Species of the World (MSW)
Mammal Species of the World (MSW)
 Système d'information taxonomique intégré (ITIS)
Système d'information taxonomique intégré (ITIS)
* Liens externes
 Global Biodiversity Information Facility (GBIF)
Global Biodiversity Information Facility (GBIF)
* Bibliographie
 Temminck, C.J., 1820. Hyaena picta. Annales Générales des Sciences Physiques, Vol. 3, pp. 54, pl. 35. (La description originale de l'espèce).
Temminck, C.J., 1820. Hyaena picta. Annales Générales des Sciences Physiques, Vol. 3, pp. 54, pl. 35. (La description originale de l'espèce).
 Brookes, J., 1827. Lycaon tricolor. Transactions of the Linnean Society of London, Vol. 15, Part 1, p. 151. (La création du genre Lycaon).
Brookes, J., 1827. Lycaon tricolor. Transactions of the Linnean Society of London, Vol. 15, Part 1, p. 151. (La création du genre Lycaon).
 Creel, S. & Creel, N.M., 2002. The African Wild Dog: Behavior, Ecology, Conservation. Princeton University Press.
Creel, S. & Creel, N.M., 2002. The African Wild Dog: Behavior, Ecology, Conservation. Princeton University Press.
 Kingdon, J., 1997. The Kingdon Field Guide to African Mammals. Academic Press.
Kingdon, J., 1997. The Kingdon Field Guide to African Mammals. Academic Press.
 Nowak, R., 1999. Walker's Mammals of the World Sixth Edition. The Johns Hopkins University Press.
Nowak, R., 1999. Walker's Mammals of the World Sixth Edition. The Johns Hopkins University Press.
 Fuller, T.K. & Kat, P.W., 1990. Movements, activity, and prey relationships of African wild dogs (Lycaon pictus) near Aitong, south-western Kenya. African Journal of Ecology.
Fuller, T.K. & Kat, P.W., 1990. Movements, activity, and prey relationships of African wild dogs (Lycaon pictus) near Aitong, south-western Kenya. African Journal of Ecology.
 Mills, M.G.L. & Gorman, M.L., 1997. Factors affecting the density and distribution of wild dogs in the Kruger National Park. Conservation Biology, Vol. 11, No. 6, pp. 1397-1406.
Mills, M.G.L. & Gorman, M.L., 1997. Factors affecting the density and distribution of wild dogs in the Kruger National Park. Conservation Biology, Vol. 11, No. 6, pp. 1397-1406.
 Hayward, M.W., et al., 2006. Prey Preferences of the African Wild Dog Lycaon pictus (Canidae: Carnivora): Ecological Requirements for Conservation. Journal of Mammalogy, Vol. 87, No. 6, pp. 1122-1131.
Hayward, M.W., et al., 2006. Prey Preferences of the African Wild Dog Lycaon pictus (Canidae: Carnivora): Ecological Requirements for Conservation. Journal of Mammalogy, Vol. 87, No. 6, pp. 1122-1131.
 Woodroffe, R., et al., 2007. African wild dogs Lycaon pictus decline despite conservation efforts. Oryx, Vol. 41, No. 2, pp. 147-152.
Woodroffe, R., et al., 2007. African wild dogs Lycaon pictus decline despite conservation efforts. Oryx, Vol. 41, No. 2, pp. 147-152.
 Crossey, B., Chimimba, C., Du Plessis, C., Ganswindt, A., & Hall, G., 2021. African wild dogs (Lycaon pictus) show differences in diet composition across landscape types in Kruger National Park, South Africa. Journal of Mammalogy, Vol. 102, Issue 5, pp. 1211–1221.
Crossey, B., Chimimba, C., Du Plessis, C., Ganswindt, A., & Hall, G., 2021. African wild dogs (Lycaon pictus) show differences in diet composition across landscape types in Kruger National Park, South Africa. Journal of Mammalogy, Vol. 102, Issue 5, pp. 1211–1221.


